Առաջին տարրը՝ Ջրածին
Ջրածնի ատոմի կառուցվածքը ՝

Միացություններ առաջացնելիս ջրածինը հիմնականում ցուցաբերում է մետաղական հատկություն, այսինքն՝ տալիս է մեկ էլեկտրոն և ձեռք է բերում +1 լիցք:
H0−1e→H+
Իսկ որոշ պայմաններում ոչ մետաղական հատկություն` ընդունում է էլեկտրոն (օրինակ՝ մետաղների հետ առաջացած միացություններում) և ձեռք բերում −1 օքսիդացման աստիճան:
H0+1e−→−H−
Միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11%-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ: Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա լրիվ կազմված է ջրածին քիմիական տարրից: Ցածր ջերմաստիճանի և շատ բարձր ճնշման պատճառով ջրածինն այդ մոլորակի վրա գտնվում է պինդ վիճակում:
Ջրածինը անհոտ, անգույն, օդից 14,5 անգամ թեթև գազ է:Ջրում գործնականորեն չի լուծվում (սովորական պայմաններում 100 լ ջրում լուծվում է 2 լ ջրածին, հեղուկանում է՝ −253°C: Սովորական պայմաններում ջրածին պարզ նյութը՝ H2, փոխազդում է միայն ֆտորի հետ, իսկ քլորի հետ՝ լույսի ազդեցության տակ: Բազմաթիվ քիմիական տարրերի ատոմների հետ այն փոխազդում է տաքացման պայմաններում:

1. Ջրածնի փոխազդեցությունը մետաղների հետ
Բարձր ջերմաստիճանում ջրածինն անմիջականորեն փոխազդում է որոշ մետաղների հետ (հիմնականում ալկալիական և հողալկալիական)՝ առաջացնելով մետաղների հիդրիդներ: Օրինակ 1՝ H2+2Na=2NaH
Երկրորդ տարրը՝ Նատրիում
| 11 | Նատրիում |
| Na22,989 | |
| 3s1 |
Նատրիում, քիմիական տարր է, քիմիական բանաձևն է Na (լատ.՝ Natrium)։ 3-րդ պարբերության 1-ին խմբի տարր, կարգահամարը՝ 11, ատոմային զանգվածը՝ 22,98977։ s-տարր է, ատոմի էլեկտրոնային թաղանթների կառուցվածքն է 3s1։ K և L թաղանթները լրացված են։
Բնական նատրիումը բաղկացած է միայն 23Na կայուն իզոտոպից։ Ստացվել են 20-22, 24 և 25 ռադիոակտիվ իզոտոպները (22Na-ի T½ = 2,64 տարի)։
Նատրիումը (7440-23-5) արծաթա-սպիտակավուն, ալկալիական մետաղ է։

Պատմություն՝
Նատրիումի միացությունները՝ կերակրի աղը և սոդան, հայտնի են շատ հին ժամանակներից։ Եբրայերեն neter բառը հանդիպել է Աստվածաշնչում որպես նյութի անվանում, որը, ըստ Սողոմոնի եռացել է քացախում: Եգիպտոսում սոդան բնության մեջ հանդիպում է սոդայի լճերի ջրերում։ Բնական սոդան հին եգիպտացիները օգտագործել են զմռսելու, կտավների սպիտակեցման համար, խոհանոցում սննդի մեջ, ինչպես նաև ներկերի պատրաստման համար։
«Նատրիում» անվանումը ծագել է բառից, որը փոխ են առել Մերձավոր եգիպտական լեզվից (nṯr), որտեղ նա ունեցել է այլ նշանակություններ. «սոդա», «ուտիչ նատր»:
«Na» հապավումը և natrium բառը առաջին անգամ օգտագործել են ակադեմիկոսները, հիմնադիրը՝ շվեդ բժիշկ Հակոբոս Բերցելիուս (Jöns Jakob Berzelius, 1779-1848)։ Հետագայում տարրը անվանեցին նաև սոդա (լատ.՝ sodium)։ Sodium անվանումը հավանաբար գալիս է արաբական suda բառից, որը նշանակում է «գլխացավ», քանի որ այդ ժամանակ սոդան օգտագործում էին որպես դեղ գլխացավի համար:
Ով է ստեղծել և առաջին անգամ նկատել
Մետաղական նատրիումը առաջինն անջատել է Հ․ Դևին (1807, նոյեմբերի 19), ով առաջին անգամ այդ մասին տեղեկացրել է Բեկերսկի դասախոսություններում (իր դասախոսություններում նա նշել է, որ 1807 թվականի հոկտեմբերի 6-ին հայտնաբերել է կալիումը, իսկ նատրիումը կալիումից մի քանի օր անց)։ Նա նատրիումը ստացել է խոնավ նատրիումի հիդրօքսիդըէլեկտրոլիզի ենթարկելով։
Երրորդ տարրը՝ Թթվածին

Թթվածինը ամենատարածված քիմիական տարրն է Երկրի վրա։ Կապված թթվածինը կազմում է Երկրի ջրային շերտի զանգվածի 6/7 մասը (85,82 % ըստ զանգվածի), մթնոլորտում, որտեղ նա գտնվում է ազատ վիճակում, պարունակությամբ երկրորդն է (23,15 % ըստ զանգվածի) ազոտից հետո։ Փոփոխությունը օդում 0,1 % -ից չի անցնում։ Մթնոլորտում թթվածնի կորուստը օքսիդացման, այրման, նեխման և շնչառության պատճառով լրացվում է ֆոտոսինթեզով։
Թթվածինը առաջին տեղն է առաջացրած միներալների թվով (1364), որոնց մեջ թթվածնի պարունակությամբ գերակշռում են սիլիկատները, քվարցը, երկաթի օքսիդները, կարբոնատները և սուլֆատները։
Առաջին անգամ միմյանցից անկախ թթվածինը ստացել են շվեդ, գիտնական Շեելեն (1769-1970 թվականին՝ մագնեզիումի նիտրատի, թորակների ջերմային քայքայումից) և անգլիացի գիտնական Պրիստելին (1774 թվականին՝ սնդիկի օքսիդի և սուսրի տաքացումից).
1775 թվականին Ա. Լավուազիեն հաստատեց օդի բաղադրությունը, ցույց տվեց, որ թթվածինը համարվում է թթուների բաղադրիչ մասը և անվանեց այն oxygene — «թթու առաջացնող», այստեղից էլ հայերեն «թթվածին» անվանումը։
Թթվածինը Երկրի կեղևի ամենատարածված էլեմենտն է։ Ազատ վիճակում գտնվում է մթնոլորտային օդում, կապված ձևով մտնում է ջրի, միներալների, լեռնային ապարների, և բոլոր այն բույսերի, որոնցից կազմված են բուսական և կենդանական օրգանիզմները։Երկիր մոլորակի օդային մթնոլորտը կազմված է հիմնականում երկու գազից՝ թթվածնից (O2) և ազոտից (N2)։
Չորրորդ տարրը՝ Ծծումբ

Ծծումբ՝ S (լատ.՝ sulfur), քիմիական տարր է, որի նշանն է S և ատոմային թիվը՝ 16: Գտնվում է պարբերական համակարգի 6-րդ խմբի գլխավոր ենթախմբում։ Իսկ ջրածնի և թթվածնի միացություններում բաղկացած է տարբեր իոններներից, փոխազդում է համարյա բոլոր թթուների և աղերի հետ։ Ծծմբի աղերը քիչ են լուծվում ջրում։ Ցուցաբերում է ոչ մետաղական հատկություններ։ Ծծումբը մարդուն հայտնի է վաղնջական ժամանակներից։ Երկրակեղևում ծծմբի պարունակությունը 0,05 % է, հանդիպում է ինչպես ազատ (բնածին ծծումբ), այնպես էլ միացությունների՝ գերազանցապես սուլֆիդների, օրինակ՝ ZnS, PbS, Cu2S, FeS2, և սուլֆատների, օրինակ՝ CaSO4.2H2O, Na2SO4.10H2O, ձևով։
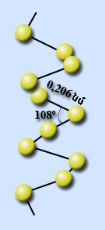
Ծծումբը գոյություն ունի հիմնականում 3 պարզ նյութի՝ տարաձևությունների տեսքով:
1. Շեղանկյուն ծծումբ — S8: Առավել կայուն ձևափոխությունն է:
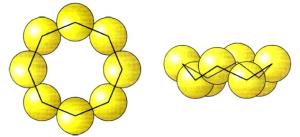
2. Ասեղնաձև (մոնոկլին) ծծումբ)` մուգ դեղին ասեղներ: Կայուն է 96℃ բարձր ջերմաստիճանում, սովորական ջերմաստիճանում փոխարկվում է շեղանկյուն ծծմբի:

3. Պլաստիկ շագանակագույն ռետինանման ամորֆ զանգված է, անկայուն է, արագ փոխարկվում է շեղանկյուն ծծմբի:

Ծծմբի ստացումը՝
1. Արդյունաբերության մեջ ստանում են` բնածին ծծումբը հալելով ջրային գոլորշիներով:

2. Ծծմբաջրածնի ոչ լրիվ օքսիդացումից (թթվածնի անբավարարության պայմաններում).

2H2S+O2→2S+2H2O
Քիմիական հատկությունները: Տարբեր ռեակցիաներում ծծումբը կարող է հանդես գալ և՛ որպես օքսիդացնող (S0+2e−→S−2), և՛ որպես վերականգնող. ( S0−2e−→S+2,S0−4e−→S+4,S0−6e−→S+6)
Ծծմբի օքսիդացնող հատկությունը՝
Ծծմբի և ալկալիական մետաղների փոխազդեցությունն ընթանում է առանց տաքացման.
2Na+S→Na2S
Ծծմբի և մյուս մետաղների փոխազդեցությունն ընթանում է տաքացման պայմաններում. Օրինակ՝ երկաթի և ծծմբի փոխազդեցությունը՝

Հինգերորդ տարրը՝ Կալիում
Կալիումը քիմիական տարր է, որի նշանն է K, պարբերական համակարգի 4-րդ պարբերության 1-ին խմբի քիմիական տարր։ Ալկալիական մետաղ է, կարգահամարը՝ 19, ատոմական զանգվածը՝ 39, 098, ատոմի արտաքին թաղանթի էլեկտրոնային կառուցվածքը՝ 4s1։ Ունի երկու կայուն՝ 39K (93, 08 %), 41K (6, 91 %), և մեկ թույլ ռադիոակտիվ իզոտոպ՝ 40K (0, 01 %), կիսաքայքայման պարբերությունը՝ T½= 1, 32• 109 տարի։

Կալիումի մի քանի միացություններ (օրինակ, պոտաշը, որն ստացվում էր փայտանյութի մոխրից) հայտնի էին դեռևս հնում։ Սակայն դրանց չէին տարբերում նատրիումի միացություններից։
Միայն 18-րդ դարին պարզվեց «բուսական ալկալու» (պոտաշի՝ K2CO3) և «հանքային ալկալու» (սոդայի՝ Na2CO3) տարբերությունը։ 1807 թվականին Հ. Դևին կծու կալիումի և նատրիումի (KOH և NaOH) էլեկտրոլիզից անջատեց կալիումը և նատրիումը ու անվանեց դրանք պոտասիում և սոդիում։ 1809 թվականին Լ. Վ. Հիլբերտը առաջարկեց անվանել «կալիում» և «նատրոնիում» Վերջինս Ի. Յա. Բերցելիուսը վերանվանեց (1811) «նատրիում»։

«Պոտասիում» և «սոդիում» անվանումները պահպանվել են Մեծ Բրիտանիայում, ԱՄՆ-ում, Ֆրանսիայում և մի քանի այլ երկրներում։
Բնության մեջ՝
Կալիումը տարածված տարրերից է, պարունակությունը երկրակեղևում՝ 2, 50 % (ըստ զանգվածի)։ Կալիումը մտնում է դաշտային սպաթների և փայլարների բաղադրության մեջ։
Վեցերորդ տարրը՝ Յոդ
Յոդը քիմիական տարր է, որի նշանն է I կամ J , տարրերի պարբերական համակարգի 6-րդ պարբերության 7-րդ խմբի տարր, կարգահամարը՝ 53, ատոմական զանգվածը՝ 126,9044։
Հալոգեն է։ Յոդը p- տարր է, ատոմի էլեկտրոնային թաղանթների կառուցվածքն է 4s24p64d105s25p5, К, L, М թաղանթները լրացված են։ Բնական յոդը բաղկացած է միայն 1271 կայուն իզոտոպից։ Ստացվել են 117-139 զանգվածի թվերով 22 ռադիոակտիվ իզոտոպներ: Քիմիական ակտիվ ոչ մետաղ է, պատկանում է հալոգեններին։
Սովորական պայմաններում յոդը մուգ մոխրամանուշակագույն, թույլ մետաղական փայլով բյուրեղական նյութ է։ Մոլեկուլը երկատոմ է (I2 բանաձևով)։

Յոդը առաջին անգամ ստացել է ֆրանսիացի քիմիկոս Բ․ Կուրտուան (1811)՝ ծովային ջրիմուռներից։ Յոդի միջին պարունակությունը երկրակեղևում 4•10−5 % է (ըստ զանգվածի) ։
Տարրի անվանումը առաջարկել է Գեյ Լուսյակը, այն ծագել է հին հուն․՝ ἰώδης — «մանուշակագույն» բառից, որը կապված է տարրի գույնի հետ։ Բժշկության և կենսաբանության մեջ այս տարրը սովորաբար անվանում են յոդ, օրինակ, «յոդի լուծույթ», համաձային հին անվանման, որը գոյություն է ունեցել դեռևս 20-րդ դարի կեսերը
Ժամանակակից քիմիական նոմենկլատուրայում օգտագործվում է յոդ անունը։ Նույն կարգավիճակը ունի նաև մի քանի այլ լեզուներով, օրինակ, գերմաներեն՝ Jod և Iod: 1950-ական թվականներին քիմիայում J տարրը փոխորինվեց I տարրով։
Հալման ջերմաստիճանը յոդի-114°C
Եռման ջերմաստիճանը յոդի-186 °C
ՅՈԴԻ ՖԻԶԻԿԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ՝
Սովորական պայմաններում յոդը մուգ մոխրամանուշակագույն, թույլ մետաղական փայլով բյուրեղական նյութ է, խտությունը՝ 4940 կգ/մ3, հալման ջերմաստիճանը՝ 114°С, եռմանը՝ 186°С։ Հեշտ ցնդող է, դանդաղ տաքացնելիս սուբլիմվում է։
Մոլեկուլը երկատոմանի է՝ 12։ Վատ է լուծվում ջրում (0,33 գ/լ, 25 °С), լավ՝ օրգանական լուծիչներում, ծծմբածխածնում, յոդիդների ջրային լուծույթներում։ Յոդը ոչ մետաղ է, քիմիապես ակտիվ, միացություններում ունի -1, +1, +3, +5 կամ + 7 օքսիդացման աստիճան։ Ջրում վատ է լուծվում, իսկ որոշ օրգանական լուծիչներում (էթիլ սպիրտ, ծծմբաջրածին, CCl4)՝ լավ։
Տաքացնելիս գոլորշիանում է առանց հեղուկ վիճակի անցնելու(սուբլիմվում է), օսլայի հետ առաջացնում է կապույտ գույնի կոմպլեքս միացություն։ Յոդը մուգ մոխրամանուշակագույն, թույլ մետաղական փայլով բյուրեղական նյութ է։ Բյուրեղները գրաֆիտ են հիշեցնում և ունեն էլեկտրական հոսանք հաղորդելու հատկություն։ Սակայն, ի տարբերություն գրաֆիտի ու մետաղների մեծամասնության, պինդ յոդը ցնդող է և հեշտորեն վերածվում է գոլորշու։ Այդ երևույթը կոչվում է սուբլիմացում։ Յոդը ջրում լուծվում է դժվարությամբ, իսկ օրգանական լուծիչներում՝ հեշտությամբ։
ՅՈԴԻ ՔԻՄԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆՆԵՐԸ՝
Յոդը պատկանում է հալոգենների խմբին։ Ատոմի էլեկտրոնային թաղանթների կառուցվածքն է՝
1s22s22p63s23p63d104s24p64d105s25p5։
Քիմիական ակտիվությամբ և օքսիդիչ հատկություններով զիջում է քլորին և բրոմին։ Յոդի և ջրածնի միացման ռեակցիան դարձելի է։
- С մետաղների հետ յոդը հեշությամբ փոխազդում է, նույնիսկ ցածր ջերմաստիճանում, առաջացնելով յոդիտներ.
- С ջրածնի հետ յոդը փոխազդում է միայն տաքացման պայմաններում, առաջացնելով յոդաջրածին.
- Յոդը հանդիսանում ավելի թույլ օքսիդիչ է քան ֆտորը, քլորը, բրոմը։

Թթվածնի, ազոտի և ածխածնի հետ անմիջականորեն չի միանում։ Հեշտությամբ միանում է բազմաթիվ ոչ մետաղների (Si, P և այլն) և մետաղների մեծ մասի հետ։ Յոդական թթուն՝ НJO3, քլորական և բրոմական թթուների համեմատ ավելի թույլ թթու է, բայց կայուն։
- Նյութի անվանումը-յոդ
- Ագրեգատային վիճակ-Պինդ
- Գույն-մուգ մանուշակագույն,սև
- Հոտ—
- Համ—
- Հալման ջերմաստիճանը-114°С
- Եռման ջերմաստիճանը-186°С
- Լուծելիությունը ջրում-քիչ
ՖԻԶԻՈԼՈԳԻԱԿԱՆ ՀԱՏԿՈՒԹՅՈՒՆԸ՝
- Կարող են քայքայել շնչառական օրգանները
- Նույնիսկ փոքր քանակության գազերի ներշնչումը օրգանիզմ առաջացնում է սուր,տհաճ զգացողություններ,որոնք հաջորդվում են հազով և շնչահեղձությամբ։
- Այն կարող է հանգեցնել թոքային հյուսվածքի վնասման և հեղուկի կուտակմանը թոքերում,որը կարող է մահացու լինել։

- Առկա է բոլոր կենդանի օրգանիզմներում և բույսերում։
- Կենդանիների և մարդկանց օրգանիզմում յոդը մտնում է վահանագեղձի արտադրված հորմոնների բաղադրության մեջ։
- Յոդի լուծույթը օգտագործվում է վերքերը մանրէազերծելու համար։
- Յոդի 3 գրամի շփումը մարսողական օրգանների հետ մահացու է։
Յոդի կենսաբանական նշանակությունը՝
Նյութափոխանակություն և կարգավորում օրգանիզմում։
Յոդը կրառվում է բշկության մեջ,լուսանկարչության մեջ,շիկացման լամպերի համար,արհեստական կաուչուկի ստացման պրոցեսին,հատուկ ապակու ստացման համար։

Տեսանյութեր՝
Յոթերորդ տարրը՝ Տիտան
Տիտան, քիմիական նշանը՝ Ti, պարբերական համակարգի 4 պարբերության 4 խմբի տարր, կարգահամարը՝ 22, ատոմական զանգվածը՝ 47,90։ d-տարր է, ատոմի արտաքին էլեկտրոնային թաղանթների կառուցվածքն է 3s2Зр63d24s2։ К և L թաղանթները լրացված են։
Բնական տիտանը բաղկացած է 46Ti (7,95 %), 47Ti (7,75 %), 48Ti (73,45 %), 49Ti (5,51 %) և 50Ti (5,34 %) կայուն իզոտոպներից։ Ստացվել են 41Ti (T1/2 = 0,09 վ,β+), 43Ti (0,6վ, β+), 44Ti (48,2 տարի), 45Ti (3,1 ժամ, β+), 51Ti (5,8 ր, β) և 52Ti (49 ր, β) ռադիոակտիվ իզոտոպները։
Տիտանը բաց մոխրագույն, արծաթափայլ մետաղ է, հալման ջերմաստիճանը՝ 1668 °С, եռմանը՝ 3330 °С, խտությունը 4505 կգ/մ3 (α-ձև 20 °С)։

Մաքուր, անխառնուրդ տիտան հաջողվել է ստանալ նրա միացությունների հայտնագործումից միայն 100 տարի հետո։ 18-րդ դարի վերջին, միմյանցից անկախ, տիտանի օքսիդ ստացել են անգլիացի գիտնական Վ. Գրեգորը (1790 թվականին) և գերմանացի քիմիկոս Մ. Կլապրոտը (1795 թվականին)։
1825 թվականին շվեդ քիմիկոս և հանքաբան Հ. Բերցելիուսին հաջողվել է ստանալ մետաղական տիտան։ 1925 թվականին ստացել են մաքուր տիտան՝ տիտանի յոդիդի տաքացմամբ (նիդերլանդացի քիմիկոսներ Ա․ վան Արկել և Հ․ դի Բուր)։ Տիտանի պարունակությունը երկրակեղևում 0,57% է (տարածվածությամբ 9-րդ տարրն է)։ Ամերիկացի քիմիկոս Մ․ Հանտերը (1910) ստացավ մաքուր (99 %) տիտան, որը պլաստիկ է միայն բարձր ջերմաստիճաններում։
Ութերորդ տարրը՝ Ամերեցիում

Ամերիցիում՝ քիմիական նշանը՝ Am (կարդացվում է «ամերիցիում»)։ Արհեստական ճանապարհով ստացված ռադիոակտիվ քիմիական տարր է՝ 95 ատոմային թվով։ Ակտինոիդ է։ Տեղակայված է պարբերական համակարգի 7-րդ պարբերության 3B խմբում։

Միացություններում ցուցաբերում է +2-ից +7 օքսիդացման աստիճաններ, ավելի շատ բնութագրական է +3-ը (վալենտականությունը՝ 3)։ Ամերիցիումի նեյտրալ ատոմի շառավիղը 0.174 նմ է, Am3+, Am4+, Am5+ և Am6+ իոնները՝ համապատասխանաբար 0.0962, 0.0888, 0.0860 և 0.0800 նմ։
Ամերիցիումն առաջին անգամ ստացվել է 1944-1945 թվականների մի խումբ ամերիկացի հետազոտողների կողմից (Գ. Սիբորգ, Ռ. Ջեյմս, Լ. Մորգան, Ա. Գիորսո)՝ պլուտոնիում-239-ը նեյտրոններով ճառագայթելով։ Պլուտոնիում-239-ի միջուկը նեյտրոն կլանելուց հետո ենթարկվում է β վերափոխման, ինչի արդյունքում ստացվում է ամերիցիում-240:
Անվանումը ստացվել է «Ամերիկա» բառից՝ նույն սկզբունքով, ինչ Եվրոպիումը, որը լանթանոիդների ընտանիքում զբաղեցնում է նույն՝ 6-րդ տեղը, ինչպես ամերիցիումը՝ ակտինոիդների ընտանիքում։
Իններորդ տարրը՝ Հելիում
Հելիում լատ.՝ Helium, գտնվում է Մենդելևի պարբերական համակարգի երկրորդ խմբի գլխավոր ենթախմբում, որի նշանն է He և ատոմային թիվը՝ 2։ Իներտ գազ է, կարգահամարը՝ 2, ատոմական զանգվածը՝ 4,0026:
Բնածին հելիումը բաղկացած է երկու կայուն իզոտոպից՝ 3He և 4He (վերջինը անհամեմատ շատ է)։

Հելիումը տիեզերքում ամենատարածված տարերից է, զբաղեցնում է երկրորդ տեղը՝ ջրածնից հետո։ Բացի այդ հելիումը քիմիական նյութերում երկրորդ տարրն է իր փափկությամբ (ջրածնից հետո)։ Գոյություն ունեցող բոլոր հայնտի նյութերից ունի ամենացածր եռման ջերմաստիճանը։
Պատմությունը՝
1868 թվականին ֆրանսիացի Ժ. ժանսենը և անգլիացի Զ. Ն. Լոկիերը արեգակի սպեկտրում հայտնաբերեցին վառ դեղին գիծ, որը չէր վերագրվում այդ ժամանակ հայտնի որևէ տարրի։ 1871 թվականին Զ. Ն. Լոկիերը պարզեց, որ դա նոր տարր է Արեգակի վրա և անվանեց «Հելում» (հին հուն․՝ ἥλιος — «Արեգակ»)։ 1895 թվականին անգլիացի Ու. Ռամզայը ռադիոակտիվ կլևեիտ հանքաքարերի տաքացումից անջատված գազի սպեկտրում գտավ նույն դեղին գիծը:Երկրի վրա հելիում քիչ է. 1 մ3 օդը պարունակում է 5,24 սմ3 հելիում, իսկ երկրի յուրաքանչյուր կիլոգրամ նյութը՝ 0,003 մգ։ Տիեզերքում ըստ տարածվածության հելիումը երկրորդն է՝ ջրածնից հետո, երկրի վրա 4He իզոտոպը մշտապես առաջանում է ուրանի, թորիումի և ռադիոակտիվ այլ տարրերի տրոհմամբ։ Երկրակեղևում հելիումի պարունակությունը 3•10−7 % է (ըստ զանգվածի)։ 4He+ ատոմի միջուկները (բաղկացած են 2 պրոտոնից և 2 նեյտրոնից) կոչվում են ալֆա-մասնիկներ: 4He-ում նուկլոնների (պրոտոնների և նեյտրոնների) կապի էներգիան ունի առավելագույն արժեք (28,2937 ՄԷՎ), որի պատճառով էլ ջրածնի միջուկներից (պրոտոններից) 4He-ի միջուկների առաջացումն ուղեկցվում է մեծ քանակությամբ էներգիայի անջատմամբ։ Համարում են, որ այդ միջուկային ռեակցիան՝41H = 4He + 2β+ + 2υ։ Արեգակի և նման այլ աստղերի էներգիայի հիմնական աղբյուրն է։
Տասերորդ տարրը՝ Գերմանիում
Գերմանիում (լատ.՝ Germanium), Ge, տարրերի պարբերական համակարգի 5-րդ պարբերության 4-րդ խմբի քիմիական տարր, կարգահամարը՝ 32, ատոմական զանգվածը՝ 72,60։ Ունի հինգ կայուն իզոտոպ՝ 70Ge, 72Ge, 73Ge, 74Ge և 75Ge համապատասխանաբար՝ 20,55%, 27,35%, 7,78%, 76 5% և 7,86%։

Արհեստականորեն ստացվել են գերմանիումի բազմաթիվ ռադիոակտիվ իզոտոպները։ Գերմանիումը p տարր է, նրա ատոմի արտաքին Էլեկտրոնային թաղանթի կառուցվածքն Է՝ 4s24p2։ Գերմանիումը հայտնաբերել է գերմանացի քիմիկոս Կ․ Վինկլերը (1886) և անվանել ի պատիվ իր հայրենիքի։
1869 թվականին ռուս քիմիկոս Դմիտրի Մենդելեևը հայտնեց մի քանի քիմիական տարրերի գոյություն մասին, այդ թվում նաև գերմանիումի։ 1870 թվականի դեկտեմբերի 11-ին Մենդելեևը իր հոդվածում որոշել էր տվյալ տարրի ատոմային զանգվածը և հատկությունները։
1885 թվականին Ֆրայբերգը հանքավայրերից մեկում հայտնաբերեց մի նոր հանքաքար։ Գերմանացի քիմիկոս Կլեմեքս Վինկլերը քիմիական անալիզի ժամանակ հայտնաբերեց մի նոր քիմիական տարր։ 1886 թվականին գիտնականներին հաջողվեց հայտնաբերել այդ տարրը։
Վինկլերը նոր տարրը բացահայտելուց հետո այն անվանեց Germanium, իսկ քիմիական նշանը՝ Ge: 1886-1887 թվականներին Վինկլերը մանրամասն նկարագրեց գերմանիումի հատկությունները։ Սկզբում Վինկլերը ցանկանում էր տարրը անվանել «նեպտունիում», բայց այդ անվանումը արդեն տրվել էր մեկ ուրիշ տարրի, այդ պատճառով էլ անվանեցին ի պատիվ իր հայրենիքի՝ Գերմանիա:

Ֆիզիկական հատկությունները՝
Գերմանիումը բաց մոխրագույն, փխրուն պինդ նյութ է,
- հալման ջերմաստիճանը՝ 937,5 °C,
- եռմանը՝ 2700 °C,
- խտությունը՝ 5327 կգ/մ3։
Թափանցիկ է ինֆրակարմիր ճառագայթների համար, կիսահաղորդիչ է (ΔЕ= 0,69 էվ, 1,104 10−19 ջ, 25 °С)։ Խառնուրդների ակայությունը և տաքացումը մեծացնում են նրա էլեկտրահաղորդականությունը։ Ստացված ամենամաքուր գերմանիումի տեսակարար դիմադրությունը՝ 60 օհմ•սմ (25 °C)։
Միացություններում 2 և 4 արժեքանի է։ Մետաղների լարման շարքում գտնվում է պղնձի և արծաթի միջև։ Սովորական ջեմաստիճաններում կայուն է օդի, ջրի, ալկալիների և նոսր թթուների նկատմամբ։ Ազոտական թթվում և խիտ ծծմբական թթվում օքսիդանում է։ Հեշտությամբ լուծվում է արքայաջրում և H2O2 պարունակող ալկալիների լուծույթներում։
10 քիմիական տարրերի պատմությունը՝ տեսանյութում՝
Իմ տեսանյութը:
