Տարրի բնութագրումը`
1) քիմիական տարրի նշանը
Mg — մագնեզիում — magnesium

2) կարգաթիվ— 12 /12 պրոտոն և էլեկտրոն/
միջուկի լիցքը + 12
3) հարաբերական ատոմային զանգվածը
զ․ա․մ 1,66⋅10−27կգ, կամ 1,66⋅10−24գ
հարաբերական ատոմային զանգված — 24․350
Հարաբերական ատոմային զանգվածը չափողականություն չունի, այն հարաբերական մեծություն է:
Տարրի հարաբերական ատոմային զանգվածը ցույց է տալիս, թե այդ տարրի մեկ ատոմի զանգվածը (m0) քանի՞ անգամ է գերազանցում զանգվածի ատոմային միավորը:
(m0) (Mg)=24
4)մեկ ատոմի զանգվածը (գ)
(m0) (Mg)= (m0) (Mg)=24*1,66*10 -27 , 24*1,66*10 -26=3,9*10-26 կգ,կամ 3,9*10-23 գ
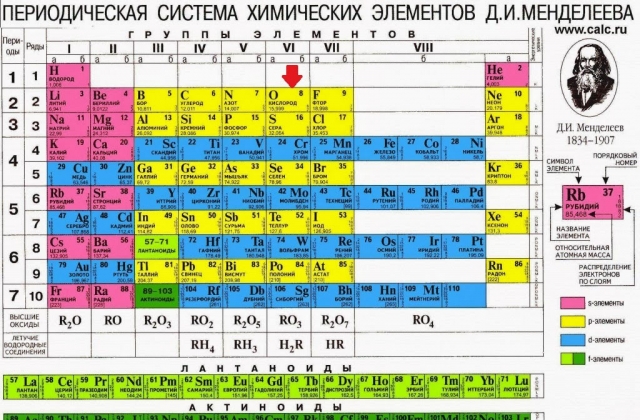
5) Դիրքը պարբերական համակարգում“ո՞ր պարբերության տարր է,խումբը,ենթախումբը
3 պարբերության,2 խումբ,3 շարք,գլխավոր ենթախումբ

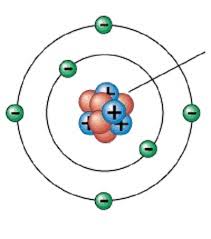
6) Ատոմի բաղադրությունը՝
Ատոմը բաղկացած է նեյտրոնից,էլեկտրոնից և պրոտոնից,նաև միջուկից
Կարգաթիվ-12
Նեյտրոն-n-0
Պրոտոն-p-12
Էլեկտրոն-e-12
Միջուկի լիցքը- /+/
Ատոմի լիցքը-չեզոք
n=հ․ա․զ․-կարգաթիվ,քանի էլեկտրոնը 2000 անգամ փոքր է ,դրա համար այն նշանակում ենք 0։
Ստացվում է 24-12=12
n=12
p=12,n=12,e=12
7)էլեկտրոնային թաղանթի կառուցվածքը
Քանզի գտնվում է 3 պարբերությունում,ուստի ունի 3 էլեկտրոնային շերտ
1 շերտ — 2
2 շերտ- 8
3 շերտ — 2
Քանի,որ երրորդ շերտում 4-ից պակաս էլեկտրոն ունեցող ատոմները կորցնում են էլեկտրոնները,մագնեզիումը նույնպես կորցնում է վերջին շերտի էլեկտրոնները,այն չի կարող վերցնել ուրիշ ատոմից։
| (2) | (8) |(2)
8)ինչպիսի՞ տարր է` մետաղ է, թե՞ ոչմետաղ
Մետաղ է,որովհետև ունի մետաղական փայլ,նաև մետաղական հատկություններ
9) Օքսիդացման աստիճանը`ՕԱ
Օքսիդացման աստիճանն է 2
10)իզոտոպներ
Mg-24, Mg-25 եւ Mg-26՝կայուն իզոտոպներ
11)
1․հավաքել տեղեկություններ այդ տարրի մասին՝տարածվածությունը,հատկությունները,որ նյութերի բաղադրության մեջ է մտնում այդ տարրը,այդ նյութերի կիրառումը:
Տարածվածություն․
Երկրակեղևում կազմում է մոտ 2%։ Հանդիպում է հիմնականում կարբոնատների (MgCO3, CaCO3), սուլֆատների (MgSO4՝ ծովի ջուր) սիլիկատների և ալյումասիլիկատների ձևով։Ընդերքում ամենատարածվածն է, մեծ քանակներով գտնվում է ծովի ջրերում
Հատկություններ․
Ֆիզիկական
Սովորական պայմաններում մագնեզիումի խտությունը 20 °C-ում — 1,738 գ/սմ³ է։ Հալման ջերմաստիճանը 650 °C է, իսկ եռման՝ 1090 °C:
Քիմիական
1․Փոխազդում է օդի հետ և ազոտի հետ, այս ռեակցիաները միացման են և ուղեկցվում են ջերմության անջատմամբ։
2․Մագնեզիումը տաքացման պայմաններում և ճնշման տակ միանում է ջրածնի հետ՝ առաջացնելով հիդրիդներ։
3․Մագնեզիումը փոխազդում է նաև այլ ոչ մետաղների հետ։
4․Լինելով ուժեղ վերականգնիչ փոխազդում է ոչ մետաղների օքսիդների հետ.
5․Մագնեզիումը բուռն փոխազդում է թթուների հետ՝ առաջացնելով ջրածին.
Կիրառում․
Զգալի քանակներով մագնեզիում օգտագործվում է այլ մետաղների արտադրության համար։ Գործնական մեծ նշանակություն ունեն մագնեզումական համաձուլվածքներըորոնք մագնեզիումից բացի պարունակում են նաև Al Mn, Zn րայլ տարրեր։
Այն օգտագործվում է թեթև և ուլտրամանուշակագույն ձուլվածքների համաձուլվածքներ արտադրելու համար (ինքնաթիռների կառուցում, ավտոմոբիլային արտադրություն), ինչպես նաև պիրոտեխնիկայում և ռազմական գործերում լուսավորության և հրկիզման հրթիռների արտադրության համար: 20-րդ դարի երկրորդ կեսից ի վեր մաքուր մագնեզիումը և սիլիկոն-երկաթի խառնուրդի ֆերոսիլիկոմագնեզիումի բաղադրության մեջ սկսեցին լայնորեն կիրառվել երկաթե ձուլարանում իր ունեցվածքի հայտնաբերման պատճառով, չուգուն երկաթով գրաֆիտի ձևի վրա ազդելու համար, ինչը հնարավորություն տվեց ստեղծել նոր եզակի կառուցվածքային նյութեր մեխանիկական տեխնիկայի համար:
Բժշկության մեջ․
Մագնեզիումի կենսաբանական նշանակությունը նույնպես էական է։ Բժշկության մեջ, որպես դեղամիջոց, օգտագործում են մագնեզիումի սուլֆատը, օքսիդը և կարբոնատը։ Այդ մետաղն անհրաժեշտ է մկանների և նյարդային համակարգի ճիշտ գործունեության համար։ Մարդու օրգանիզմը պարունակում է մոտ 25 գ մագնեզիում, որի մեծ մասը գտնվում է ոսկորներում։ Մարդը մագնեզիում է յուրացնում բանջարեղենի միջոցով. բոլոր կանաչ բույսերը պարունակում են քլորոֆիլ, առանց որի, ինչպես գիտեք, անհնար է ֆոտոսինթեզը։
Օգտագործում են կոսմետիկական և ատամի մածուկների արտադրության մեջ, ռենտգենյան ախտորոշման միջոց, ներկերի և գունանյութերի արտադրության մեջ, առնետների ոչնչացման միջոց։
3.Տարրի հայտնագործումը և անվանակարգը
1695-ին Անգլիայում Epsom աղբյուրի հանքային ջրից ստացվեց աղ, որը դառը համ և մեղմ ազդեցություն ունեցավ: Դեղագործներն այն անվանել են «դառը աղ», ինչպես նաև «անգլիական» կամ «Epsom »:
Հանքային էպսոմիտը մագնեզիումի սուլֆատ բյուրեղային հիդրատ է և ունի քիմիական բանաձև MgSO4 · 7H2O:
Տարրքի լատինական անվանումը գալիս է Փոքր Ասիայի հինավուրց Մագնեզիա քաղաքի անվան տակ, որի հարևանությամբ կան մագնեզիտային հանքանյութի հանքավայրեր: 1808 թվականին անգլիացի քիմիկոս Համֆրի Դեյվը, օգտագործելով մագնեզիայի և սնդիկի օքսիդի խոնավեցված խառնուրդի էլեկտրոլիզը, ձեռք բերեց անհայտ մետաղի ամալգա, որին տրվեց «մագնեզիում» անվանումը, որը մինչ օրս պահպանվում է շատ երկրներում:

Խտությունը — 1,738 գ/սմ³
Եռման ջերմաստիճանը — 1090 °C
Հալման ջերմաստիճանը — 650 °C
Էլեկտրական հաղորդականություն — Այո
Տարածվացությունը բնության մեջ։
1.94%
Մագնեզիումի միացություններ
MgCO3
- Մագնեզիումի կարբոնատ
- Մագնեզիում,ածխածին,թթվածին
- 5 ատոմ՝1 մոլեկուլ մգ
- Mr(MgCO3)=24+12+16*3=84
- M(Mg):m(C):(O)=24/12/48
- W(Mg)=24/84*100%=29%
- W(C)=12/84*100%=14%
- W(O)=100-(29+14)=57%
MgO
- Մագնեզիումի օքսիդ
- Mg-Մագնեզիում,O=թթվածին
- 1 մոլեկուլ՝1Mg,1O
- Mr (MgO)=24+16=40
- m (Mg): m (O)=24:16
- w (Mg)=24/40*100%=60%
- w (O)=100-60=40%
Mg(NO3)2
- Մագնեզիումի նիտրատ
- Mg-Մագնեզիում,N-ազոտ,O-թթվածին
- 1 մոլեկուլ՝1Mg,2N,5O
- Mr (Mg(NO3)2=24+28+48=100
- m (Mg): m (N2) : m (O3)=24:28:48
- w (Mg)=24/100*100%=24%
- w (N2)=28/100*100%=28%
- w (O3)=100%-28-24=48%
Իմ տեսանյութը