Նախագիծ`Քիմիական տարրերի և նյութերի տարածվածությունը
Առաջարկվող թեմաները
1. Քիմիական տարրերի տարածվածությունը բնության մեջ
Ածխածին,որպես ամենատարածված տարրը բնության մեջ։

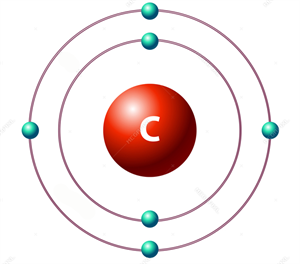
Ածխածինը մեր մոլորակում առկա է ինչպես ազատ (գրաֆիտ, ալմաստ, կոքս, մուր, ածուխ), այնպես էլ կապված վիճակում:
Ածխածինը քիմիական տարր է: Այն մարդուն հայտնի է անտիկ ժամանակներից: Բնության մեջ հանդիպում է ինչպես ազատ վիճակում, այնպես էլ միացությունների ձևով: Ածխածինն ազատ վիճակում տարածված է ալմաստի, գրաֆիտի, ածուխների ձևերով: Միացությունների ձևով այն գտնվում է նավթային կուտակումներում, օդում` ածխաթթվական գազի (CO2), իսկ Երկրի ընդերքում՝ կարբոնատների ձևով. կալցիումի կարբոնատը (CaCO3) առաջացնում է մարմարի, կավճի և կրաքարի կուտակումներ: Հայտնի են նաև դոլոմիտը (CaCO3.MgCO3), մագնեզիտը (MgCO3), երկաթասպաթը կամ սիդերիտը (FeCO3) և մալաքիտը (CuOH)2CO3: Մեծ քանակությամբ ածխածին են պարունակում բուսական ու կենդանական օրգանիզմները: Բույսերի համար ածխածնի հիմնական աղբյուրը ածխաթթվական գազն է, քանի որ բույսերն իրենց զարգացման համար անհրաժեշտ բոլոր նյութերն արևի ճառագայթների ազդեցությամբ սինթեզում են (այդ շարժընթացը կոչվում է լուսասինթեզ) ածխաթթվական գազից և ջրից, իսկ կենդանիներն ածխածինն ստանում են բույսերից` դրանցով սնվելով:




Առօրյա կյանքում հաճախ է հանդիպում ածխածին։ Օրինակ՝ մատիտն օգտագործելիս տեսնում ես ածխածին մատիտի միջուկի՝ գրաֆիտի տեսքով։ Նաև ածուխը, անգամ մատանիների ու վզնոցների վրա առկա ադամանդներն ածխածնի ձևափոխություններ են (ադամանդի դեպքում ածխածինը մշակվում է բարձր ճնշման և ջերմաստիճանի պայմաններում)։ Ավելին՝ օրգանիզմիդ (քաշի) 18%-ը կազմում են ածխածնից կազմված նյութերը։ Փաստորեն, ածխածինը օրգանզիմի մի շարք կարևոր մոլեկուլների, այդ թվում՝ ԴՆԹ-ի, ՌՆԹ-ի, սպիտակուցների, շաքարների և ճարպերի կառուցվածքային միավորն է։Այս բարդ կենսաբանական մոլեկուլները կոչվում են մակրոմոլեկուլներ։ Դրանք դասակարգվում են նաև որպես օրգանական մոլեկուլեր, ինչը նշանակում է, որ այս միացությունները կազմված են ածխածնի ատոմներից։ (Այս կանոնն ունի նաև բացառություններ, օրինակ՝ ածխածնի երկօքսիդը (ածխաթթու գազը) ու ածխածնի մոնօքսիդը (շմոլ գազը) պարունակում են ածխածին, բայց չեն համարվում օրգանական միացություններ)։
Ածխածնի՝ քիմիական կապեր առաջացնելու հատկությունները
Իսկ ինչո՞ւ է ածխածինը համարվում կառուցվածքային միավոր այդքան մեծաթիվ մոլեկուլների համար։ Ինչո՞ւ այդ դերում, օրինակ, թթվածինը չէ։ Առաջինը այն պատճառով, որ ածխածին-ածխածին կապերը սովորականից ավելի ամուր են։ Հենց այդ պատճառով ածխածինը կարող է լինել կառուցվածքային ամուր միավոր մեծ մոլեկուլների համար։ Թերևս կարևոր պատճառ է նաև ածխածնի՝ կովալենտային կապեր առաջացնելու հատկությունը։ Ածխածնի մեկ ատոմը կարող է կովալնետային կապ առաջացնել մինչև չորս ատոմի հետ, որի պատճառով ածխածինը մակրոմոլեկուլի հիմնական «կմախքը» կամ կառուցողական միավորն է։Կարող ենք զուգահեռներ անցկացնել Tinker Toy® խաղալիքների հավաքածուի և ածխածնի առաջացրած կապերի միջև։ Օրինակ՝ Tinker Toy® հավաքածուից ունես 2 և 4 անցքեր ունեցող գնդիկներ։ Եթե որպես կապակցող գնդիկ ընտրես 4 անցք ունեցող գնդիկը, ապա կկարողանաս ավելի շատ կապակցումներ առաջացնել և ավելի հեշտ կստեղծես բարդ կառուցվածք, քան եթե որպես կապակցող ընտրես 2 անցք ունեցող գնդիկը։ Ածխածնի ատոմը այլ ատոմների հետ կարող է չորս կապ առաջացնել, ինչպես 4 անցք ունեցող գնդիկը, իսկ թթվածինը կարող է երկու կապ առաջացնել, ինչպես 2 անցք ունեցող գնդիկը։Չորս այլ ատոմների հետ կապեր առաջացնելու ածխածնի ունակությունը կապված է նրա էլեկտրոնների թվի և էլեկտրոնների փոխդասավորության հետ։ Ածխածնի ատոմային թիվը 6 է (ինչը նշանակում է, որ ածխածնի չեզոք ատոմում առկա են 6 պրոտոն և 6 էլեկտրոն)։ Էլեկտրոններից 2-ը ներքին էլեկտրոնային թաղանթում են, իսկ մյուս 4-ը՝ արտաքին էլեկտրոնային թաղանթում։ Կայունության հաստատման համար, որպեսզի ածխածնի ատոմն ամբողջացնի վերջին էլեկտրոնային թաղանթը, այն պետք է ձեռք բերի ևս 4 էլեկտրոն՝ պահպանելով կայուն ութնյակի կանոնը։ Օրինակ՝ մեթանի մոլեկուլում (CH_44start subscript, 4, end subscript) ածխածինը ջրածնի 4 ատոմների հետ առաջացնում է 4 կովալենտային կապ։ Յուրաքանչյուր կապ իրենից ներկայացնում է ընդհանուր էլեկտրոնային զույգ (1 էլեկտրոն տվել է ածխածինը, 1 էլեկտրոն՝ ջրածինը)։ Այս ամենի արդյունքում կազմավորվում է ածխածնի ատոմի կայուն ութնյակը։
2.Քիմիական տարրերի տարածվածությունը տիեզերքում
Ջրածին,որպես ամենատարածված քիմիական տարրը տիեզերքում
Ջրածինը (Hydrogenium` լատիներեն ջուր ծնող) պարբերական համակարգի առաջին պարբերության՝ առաջին խմբի, մեկ կարգաթվով տարրն է:

ջրածին տարրի նշանը Ջրածնի ատոմն ունի ամենապարզ կառուցվածքը` մեկ դրական լիցքով միջուկի շուրջը սփռված է մեկ էլեկտրոն:

ջրածնի ատոմի կառուցվածքը Միացություններ առաջացնելիս ջրածինը հիմնականում ցուցաբերում է մետաղական հատկություն, այսինքն՝ տալիս է մեկ էլեկտրոն և ձեռք է բերում +1 լիցք: H0−1e→H+ Իսկ որոշ պայմաններում ոչ մետաղական հատկություն` ընդունում է էլեկտրոն (օրինակ՝ մետաղների հետ առաջացած միացություններում) և ձեռք բերում −1 օքսիդացման աստիճան: H0+1e−→−H−
Միացությունների ձևով ջրածինը չափազանց տարածված տարր է: Նա կազմում է ջրի զանգվածի 11%-ը, մտնում է բոլոր բուսական` մրգերի, բանջարեղենների, թթուների, և կենդանական նյութերի` ճարպերի, սպիտակուցների, ածխաջրերի, նավթի, և շատ այլ հանքային նյութերի բաղադրության մեջ: Նա կազմում է արեգակի և աստղերից շատերի զանգվածի կեսից ավելին: Արեգակնային համակարգի ամենամեծ մոլորակը` Յուպիտերը, համարյա լրիվ կազմված է ջրածին քիմիական տարրից: Ցածր ջերմաստիճանի և շատ բարձր ճնշման պատճառով ջրածինն այդ մոլորակի վրա գտնվում է պինդ վիճակում:

Ջրածին տարր պարունակող ցանկացած միացություն պարունակում է ջրածնի երկու իզոտոպ` պրոտիում ( 99,98) և դեյտերիում (0,02): Աննշան քանակությամբ հանդիպում է նաև երրորդ իզոտոպը` տրիտիումը:

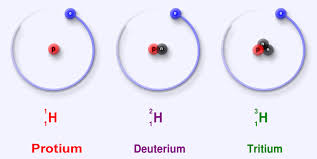
ջրածնի իզոտոպները Ջրածին տարրն առաջացնում է ջրածին պարզ նյութը՝
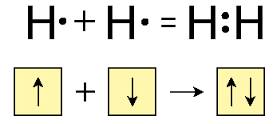
Ջրածնի մոլեկուլի բանաձևն է՝ H2, հարաբերական մոլեկուլային զանգվածը՝ 2,016 (կլորացված 2), մոլային զանգվածը՝ 2 գ/մոլ՝
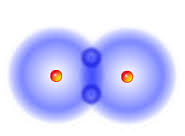
ջրածնի մոլեկուլի մոդելը Ջրածինը բնության մեջ ազատ վիճակում հանդիպում է չնչին քանակով՝ գլխավորապես մթնոլորտի վերին շերտերում: Երբեմն, այն երկրի ընդերքից դուրս է գալիս այլ գազերի հետ հրաբխային ժայթքումների, ինչպես նաև նավթի արդյունահանման ժամանակ:
1. Ջրածնի փոխազդեցությունը մետաղների հետ
Բարձր ջերմաստիճանում ջրածինն անմիջականորեն փոխազդում է որոշ մետաղների հետ (հիմնականում ալկալիական և հողալկալիական)՝ առաջացնելով մետաղների հիդրիդներ: Օրինակ 1՝ H2+2Na=2NaH

նատրիումի հիդրիդ Օրինակ 2՝ Ca+H2=CaH2

կալցիումի հիդրիդՀիդրիդները սպիտակ, իոնային կապերով, բյուրեղային նյութեր են: Մետաղների հիդրիդները ջրում հեշտությամբ քայքայվում են՝ առաջացնելով համապատասխան ալկալի և ջրածին: Օրինակ՝ CaH2+2H2O=Ca(OH)2+2H2

կալցիումի հիդրիդի և ջրի փոխազդեցությունը Մետաղների հետ փոխազդելիս ջրածնի ատոմը վերածվում է հիդրիդ իոնի՝
H0+e−=H−
3.Քիմիական տարրերի տարածվածությունը երկրակեղեվում

Սիլիցիումը,որպես ամենատարածված տարրը երկրակեղևում
Սիլիցիումի տարածվածությունը բնության մեջ և ֆիզիկական հատկությունները Սիլիցիումը, թթվածնից հետո, բնության մեջ ամենատարածված քիմիական տարրն է: Սիլիցիումը բնության մեջ ազատ վիճակում գոյություն չունի, այն հանդիպում է միացություններում և կազմում է երկրակեղևի զանգվածի 29,5 %-ը:
Սիլիցիումը, թթվածնից հետո, բնության մեջ ամենատարածված քիմիական տարրն է: Սիլիցիումը բնության մեջ ազատ վիճակում գոյություն չունի, այն հանդիպում է միացություններում և կազմում է երկրակեղևի զանգվածի 29,5 %-ը:
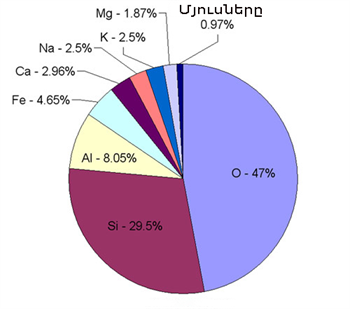
Սիլիցիումի առավել տարածված միացությունը սիլիցիումի (IV) օքսիդն է` քվարցը: Քվարցի տարատեսակն է՝ վանակնը (լեռնային բյուրեղապակի): Լեռնային բյուրեղապակու հանրահայտ տարատեսակն է ամեթիստը, այն համարվում է կիսաթանկարժեք քար: Սիլիցիումի (IV) օքսիդից է կազմված նաև սովորական ավազը:

Սիլիցիումինական միացություններից են նաև սիլիկատները և ալյումասիլիկատները: Օրինակ՝ տալկը (3MgO⋅4SiO2⋅H2O), կավը (կաոլին՝ Al2O3⋅2SiO2⋅2H2O)

Ֆիզիկական հատկություններըՍիլիցիումը մուգ մոխրագույն, մետաղական փայլով, պինդ նյութ է: Հայտնի են սիլիցիումի երկու տարաձևություն՝ ամորֆ ու բյուրեղային:

Բյուրեղային սիլիցիումը դժվարահալ է, շատ կարծր, հալվում է 1420°C և եռում 2620°C ջերմաստիճաններում: Թույլ էլեկտրահաղորդականությամբ նյութ է (կիսահաղորդիչ): Ջերմաստիճանը բարձրացնելիս սիլիցիումի էլեկտրահաղորդականությունը մեծանում է:
4.Քիմիական տարրերի տարածվածությունը մարդու օրգանիզմում և 5.Ամենենատարածված նյութը երկրագնդի վրա
Ամենատարածված թթվածին մարդու օրգանիզմում
Թթվածին պարզ նյութի բնութագիրը` Թթվածինն ազատ վիճակում առաջացնում է երկու պարզ նյութ` երկթթվածին կամ պարզապես թթվածին՝ Օ2, և եռթթվածին կամ օզոն՝ Օ3:

Թթվածնի մոլեկուլի մոդել
Օզոնի մոլեկուլի մոդելԹթվածին պարզ նյութի մոլեկուլի գրաֆիկական բանաձևն է՝ O=O: Մոլեկուլում կապն ատոմների միջև կրկնակի է, կովալենտային ոչ բևեռային:Հարաբերական մոլեկուլային զանգվածը՝ Mr (Օ2) =32Մոլային զանգվածը՝ M(Օ2) =32գ/մոլ:Մոլային ծավալը նորմալ պայմաններում՝ Vm=22,4 լ/մոլ է:Թթվածին պարզ նյութը կազմում է օդի 1/5 մասը կամ ծավալի 21 տոկոսը: Օդի թթվածինը հիմնականում ծախսվում է նյութերի այրման, օքսիդացման, օրգանական նյութերի նեխման և կենդանի օրգանիզմների շնչառության վրա: Սակայն, ծախսված թթվածինը վերականգնվում է լուսասինթեզով:
Թթվածնի ստացումըԱռաջին անգամ թթվածին ստացել են սնդիկի օքսիդի (HgO) քայքայումից: 2HgO=t°2Hg+O2

Սնդիկի օքսիդ
Արդյունաբերության մեջ թթվածին ստանում են՝
1. Հեղուկ օդից
2. Ջրի էլեկտրոլիզից 2H2Օ=2H2+O2 Լաբորատորիայում հնարավոր է ստանալ թթվածին՝ այդ տարրը պարունակող բարդ նյութերը քայքայելով:


6.Ամենատարածված գազային նյութը օդում:
Ես ընտրել եմ վերջին ուղղությունը։Ամենատարածված գազային նյութը օդում։
Ազոտ-N-Nitrogenium
Ազոտի ստացումը և հատկությունները

Ազոտը բնության մեջ հանդիպում է երկու իզոտոպների ձևով՝

Միացություններում ազոտի հիմնական օքիդացման ատիճաններն են՝
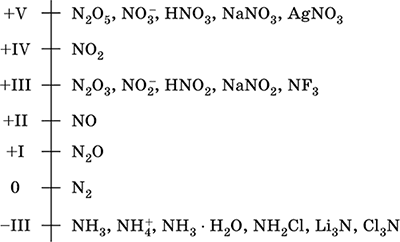
Պարզ նյութ՝ ազոտի մոլեկուլը առաջանում է այդ տարրի երկու ատոմի կենտ էլեկտրոնների զույգման շնորհիվ: Մոլեկուլում ատոմները կապված են կովալենտային ոչ բևեռային եռակի կապով, կապերից մեկը σ-կապ է, իսկ երկուսը՝ π
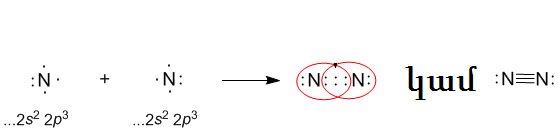
Մոլեկուլային բանաձևն է՝

Ֆիզիկական հատկությունները
Անհոտ, անհամ, ջրում քիչ լուծվող գազ է. 100լ ջրում (20°C)1,54լ ազոտ է լուծվում։ –195,8°C անգույն հեղուկ է, –209,86°C ազոտը պնդանում է ձյան տեսքով: Օդից թեթև է մոտավորապես 1,04 անգամ։

ՍտացումըԱրդյունաբերության մեջ ազոտ ստանում են հեղուկ օդի կոտորակային թորումով (հեղուկ ազոտը եռում է ավելի ցածր ջերմաստիճանում, քան հեղուկ թթվածինը)։
Լաբորատորիայում ազոտ ստանում են ամոնիումային աղերի ու նիտրիտների խառնուրդի տաքացմամբ:
Մենք քիմիայի լաբորատորիայում կատարել էինք այսպիսի մի փորձ։Մենք վառել էինք մոմը,տեղադրել ջրով խցանի մեջ։Հետո վրայից դրել էինք խողովակ,որը ամբողջովին փակում էր վառվող մոմը։Հետո վայրկյաններ անց,մոմը հանգչեց և մենք որոշեցինք օդի բաղադրությունը։Երբ այն հանգավ,թթվածնի ծավալով /մոտ 21 տոկոսով,կամ 1/5 մասով/ ջուր լցվեց խողովակի մեջ։Դրանից հետևում է,որ ինչքան ծավալով թթվածին կար,այդքան ջուր լցվեց խողովակի մեջ։Իսկ ինչու մոմը հանգչեց։Որովհետև,առանց թթվածնիա յրում չի կարող տեղի ունենալ։Այրումը տեղի է ունենում միմիայն թթվածնի շնորհիվ։Մենք կարողացանք նաև իմանալ,թե ինչքան ազոտ է պարունակում որոշ ծավալով օդը։Այն պարունակում է 78 տոկոս ազոտ։Ահա և որոշեցինք օդի բաղադրությունը։Սա իմ տեսանյութն է
Իսկ հիմա եկեք խոսանք ազոտի պատմության,կառուցման և կիռարման մասին։
Ես նաև պատրաստել եմ տեսանյութ Նիտրոգենիումի մասին,բարի դիտում
