Բովանդակությունը.
- Թթուների սահմանումը, ընդհանուր բանաձևը, դասակարգումը, թթվային մնացորդը, թթուների ստացումը լաբորատորիայում և արդյունաբերության մեջ, ֆիզիկական և քիմիական հատկությունները, կիրառումը:
Թթուների սահմանումը՝
Թթուները քիմիական նյութեր են, որոնց մոլեկուլները բաղկացած են մետաղների ատոմներով տեղակալվելու ընդունակ ջրածնի մեկ կամ մի քանի ատոմներից և թթվային մնացորդից: Երկրորդ տարբերակ՝ թթուները բարդ նյութեր են, որոնց մոլեկուլները կազմված են մեկ կամ մի քանի ջրածնի ատոմներից և թթվային մնացորդից:
Դասակարգումը՝
1. Թթուները դասակարգվում են ըստ բաղադրության՝ ըստ թթվի մոլեկուլում թթվածին տարրի ատոմների առկայության:

2. Թթուները դասակարգվում են ըստ հիմնայնության՝ ըստ մետաղի ատոմով տեղակալվելու ընդունակ ջրածնի ատոմների թվի:

Թթվային մնացորդը՝
Թթվի մոլեկուլում ջրածնի ատոմի (կամ ատոմների) հետ կապված այլ տարրերի ատոմները կամ ատոմների խմբերը, կոչվում են թթվային մնացորդ:
Օրինակ՝ ազոտական թթվի մնացորդը՝ NO3 խումբն է, ծծմբական թթվինը՝ SO4 խումբը, աղաթթվում՝ Cl ատոմը:
Թթուների ստացման եղանակները՝
Անթթվածին թթուները ստացվում են համապատասխան գազային ջրածնային միացությունները ջրում լուծելով, իսկ գազային ջրածնային միացությունները ստացվում են
ա) ջրածնի և համապատասխան ոչ մետաղի անմիջական փոխազդեցությունից.
H2+F2=2HFH2+Br2=2HBrH2+S=H2SH2+Cl2=2HCl
բ) համապատասխան աղի և մեկ այլ` ավելի ուժեղ թթվի փոխազդեցությունից.
FeS+H2SO4=FeSO4+H2S↑NaCl (պինդ) +H2SO4 (խիտ) =NaHSO4+HCl↑ (լաբորատոր եղանակ) 2NaCl (պինդ) +H2SO4 (խիտ) =Na2SO4+2HCl↑ (արդյունաբերականեղանակ)
գ) որոշ այլ փոխազդեցություններից։
Օրինակ՝ ավելի ակտիվ ոչ մետաղները դուրս են մղում պակաս ակտիվները
համապատասխան թթուներից.
2HJ + Br2 = 2HBr + J2H2S + Cl2 = 2HCl + SH2S + Cl2 = 2HCl + S

Թթվածնային թթու է ստացվում նաև այդ թթվի աղի և այլ թթվի փոխազդեցությունից, եթե.
ա) ստացվող թթուն, փոխազդող թթվի համեմատ` ցնդող է.
NaNO3 + H2SO4 = NaHSO4 + HNO3
բ) որպես ռեակցիայի արգասիք՝ ջրում անլուծելի աղ կամ թթու է առաջանում.
Na2SiO3+ 2HNO3 = H2SiO3↓ + 2NaNO3
Թթուների ֆիզիկական ու քիմիական հատկությունները՝
Առավել տարածված մի քանի թթուների հատկությունները.
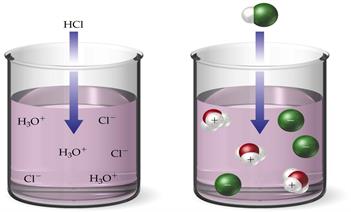
1. Աղաթթուն սուր հոտով անգույն հեղուկ է՝ քլորաջրածնի HCl ջրային լուծույթ: Նրա մոլեկուլը կազմված է ջրածնի և քլորի մեկական ատոմներից: Խիտ աղաթթուն կլանում է ջրային գոլորշիներ՝ «ծխում» է (տե՛ս նկար):
Լայնորեն կիրառվում է լաբորատորիաներում՝ ջրածին և քլոր ստանալու համար:
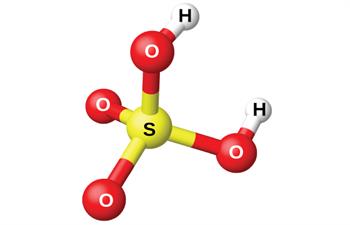
2. Ծծմբական թթուն՝ H2SO4
Յուղանման, մածուցիկ, ծանր հեղուկ է: Օդից ագահորեն կլանում է ջրային գոլորշիներ:
Ուրիշ թթուների հատկությունները՝
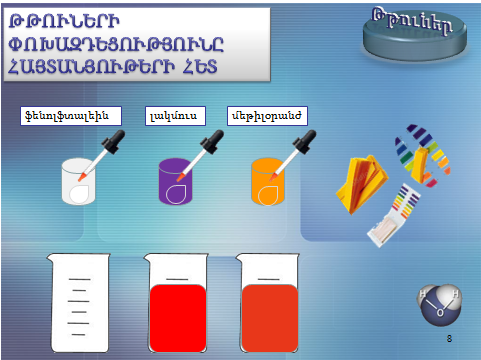
1. Թթուների փոխազդեցությունը հայտանյութերի հետ.
Բոլոր թթուների ջրային լուծույթները գունավորում են հայտանյութեր՝ լակմուսը՝ կարմիր, մեթիլօրանժը՝ մուգ վարդագույն, իսկ ֆենոլֆտալեինը թթուներում չի գունավորվում։
2. Թթուների և հիմքերի փոխազդեցությունը
Թթուներին առավել բնորոշ է հիմքերի (ինչպես ալկալիների, այնպես էլ` ջրում չլուծվող) հետ փոխազդեցությունը` չեզոքացման ռեակցիան, որի հետևանքով առաջանում է աղ և ջուր.
LiOH + HCl = LiCl + H2O
Fe(OH)2 + H2SO4 = FeSO4 + 2H2O
3. Թթուների և աղերի փոխազդեցությունը
Նման ռեակցիա իրականացնելու համար անհրաժեշտ է ելանյութերն ընտրել այնպես, որ արգասիքների թվում լինի.
ա) անլուծելի թթու.
բ) թույլ թթու.
գ) անկայուն թթու.
դ) անլուծելի աղ.
4. Որոշ թթուներ տաքացնելիս քայքայվում են.
Կիրառումը կենցաղում՝
Թթուներն ունեն «թթու» համ, օրինակ՝ բնական թթուները՝ խակ մրգերը, կենցաղում կիրառվող քացախը: Թթուներն ունեն «ուտիչ» հատկություն. քայքայում են հագուստը, մաշկը՝ առաջացնելով քիմիական այրվածք: Վտանգավոր դեպք — Եթե թթուն թափվել է մաշկի վրա, ապա պետք է շորի կտորով սրբել մաշկը, հետո լվանալ առատ սառը ջրով, այնուհետև մշակել մաշկը կերակրի սոդայով:

- Հիմքերի սահմանումը, ընդհանուր բանաձևը, դասակարգումը, ստացումը լաբորատորիայում և արդյունաբերության մեջ, ֆիզիկական և քիմիական հատկությունները, կիրառումը: Երկդիմի հիդրօքսիդներ և օքսիդներ:
Հիմքերի սահմանումը՝
Հիմքեր կամ հիդրօքսիդներ են կոչվում այն բարդ նյութերը, որոնք կազմված են մետաղի ատոմից և մեկ կամ մի քանի հիդրօքսիլ խմբերից: Իսկ հիդրոքսիլ խումբ են անվանում մետաղին միացված OH խումբը:
KOH՝ կալիումի հիդրոքսիդ
NaOH՝ նատրիումի հիդրոքսիդ
Ընդհանուր բանաձևը՝
Հիմքերի բաղադրություններում պարունակվող հիդրօքսո՝ (OH), խումբը միավալենտ է, ուստի հիմքերի բաղադրությունը արտահայտվում է հետևյալ ընդհանուր բանաձևով՝ Me(OH)n, որտեղ Me-ն մետաղն է, իսկ n-ը թվապես հավասար է տվյալ հիդրօքսիդում Me-ի օքսիդացման աստիճանին։
Դասակարգումը՝
Հիմքերը դասակարգվում են ըստ ջրում լուծվելու ունակության` լուծելի (ալկալիներ) և անլուծելի:
Ստացումը լաբորատորիայում՝
Ալկալիները (ջրում լուծելի հիմքերը) կարող են ստացվել.
• համապատասխան մետաղի ու ջրի փոխազդեցությունից՝
2Na + 2H2O = 2NaOH + H2↑
Ba + 2H2O = Ba(OH)2 + H2↑
Հիմքերի քիմիական հատկությունները՝
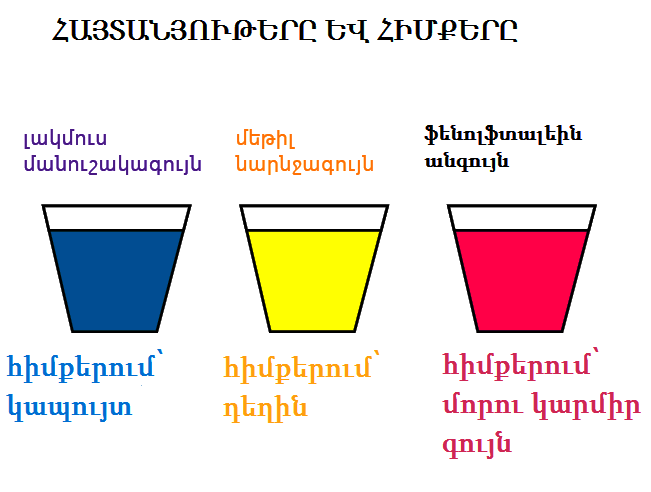
1. Հիմքերի փոխազդեցությունը հայտանյութերի հետ
Ջրում լուծելի հիմքերը` ալկալիները, գունավորում են հայտանյութերը` լակմուսը` կապույտ, մեթիլօրանժը` դեղին, իսկ ֆենոլֆտալեինը՝ մորեգույն։
2. Հիմքերի և թթուների փոխազդեցությունը
Թթուների հետ փոխազդում են և լուծվող, և անլուծելի հիմքերը՝ առաջացնելով աղ և ջուր (չեզոքացման ռեակցիա):
3. Ալկալիների և թթվային օքսիդների փոխազդեցությունը
Ba(OH)2 + CO2 = BaCO3↓ + H2OCa(OH)2 + SO2 = CaSO3↓ + H2O
4. Ալկալիների և աղերի փոխազդեցությունը
Այս փոխազդեցությունը հանգեցնում է նոր հիմքի և նոր աղի առաջացման։ Ըստ որում` ելանյութ աղը պետք է ջրում լուծելի լինի, իսկ արգասիքների թվում կամ անլուծելի հիմք,
կամ անլուծելի աղ լինի՝
5. Ալկալիների և ոչ մետաղների փոխազդեցությունը
Ոչ մետաղներից ալկալիները փոխազդում են, հիմնականում հալոգենների հետ։ Այս դեպքում, որպես կանոն` կրկին աղ և ջուր են առաջանում, օրինակ՝
6. Անլուծելի հիմքերի քայքայումը
Երկդիմի հիդրօքսիդներ՝
Նյութերը, որոնք ցուցաբերում են և՛ թթվային, և՛ հիմնային հատկություններ, անվանվում են երկդիմի (ամֆոտեր)։ Երկդիմությունը (ամֆոտերությունը) նյութի հատկությունն է` փոխազդելու և՛ թթուների, և՛ հիմքերի հետ։
- Աղեր, դասակարգումը, ստացման եղանակները, ֆիզիկական և քիմիական հատկությունները, կիրառման բնագավառները:
Աղերի սահմանումը՝
Աղերը բարդ նյութեր են, որոնք կազմված են մետաղների ատոմներից և թթվային մնացորդներից։ Աղերն անվանելիս տալիս են նրա բաղադրության մեջ մտնող մետաղի և թթվային մնացորդի անունը։ Ծծմբական թթվի աղերն անվանում են սուլֆատներ:

Դասակարգումը՝
Աղերի ստացումը՝
Աղերի ստացման եղանակները հիմնված են անօրգանական միացությունների քիմիական հատկությունների վրա:
Աղերի ստացման հիմնական եղանակներն են.
1. հիմքի և թթվի փոխազդեցությունը՝
2. ալկալու և թթվային օքսիդի փոխազդեցությունը՝
2NaOH + CO2 = Na2SO3+ H2O
3. ալկալու և լուծելի աղի փոխազդեցությունը (եթե ջրում չլուծվող հիմք է առաջանում)՝
2KOH + CuCl2 = Cu(OH)2↓ + 2KCl
4. հիմնային օքսիդի ու թթվային օքսիդի փոխազդեցությունը՝
MgO + CO2 = MgCO3
5. թթվի ու հիմնային օքսիդի փոխազդեցությունը՝
CuO + 2HCl = CuCl2+ H2O
6. թթվի ու աղի փոխազդեցությունը, եթե անլուծելի թթու, անլուծելի աղ կամ պակաս ցնդող թթու է առաջանում՝
AgNO3 + HCl = AgCl↓ + HNO3
7. թթվի ու մետաղի փոխազդեցությունը՝
Zn + 2HCl = ZnCl2 + H2↑
8. երկու աղի լուծույթների փոխազդեցությունը, եթե որպես ռեակցիայի արգասիք անլուծելի աղ է առաջանում՝
K2CO3+ MgSO4= MgCO3↓ + K2SO4
9. աղի լուծույթի ու մետաղի փոխազդեցությունը, եթե մետաղը ջրի հետ անմիջականորեն չի փոխազդում և մետաղների համեմատական ակտիվության շարքում աղի բաղադրությունում առկա մետաղի համեմատ ձախ է տեղադրված՝
Zn+CuSO4=ZnCl2+CuCu+2AgNO3=Cu(NO3)+22Ag
10. մետաղի ու ոչ մետաղի փոխազդեցությունը՝
Ca + S = CaSZn+Br2=ZnBr2
Աղերի կիրառումը՝
Աղերը լայն կիրառություն ունեն կենցաղում: Կերակրի աղը կամ նատրիումի քլորիդը (NaCl) անփոխարինելի է սննդի մեջ:
Հրուշակեղենի և հանքային ջրերի արտադրությունում օգտագործում են նատրիումի հիդրոկարբոնատը NaHCO3` սննդի սոդան:
Оճառի նաև ապակու արտադրության մեջ օգտագործվում է նատրիումի կարբոնատը Na2CO3, որը հայտնի է նաև լվացքի սոդա անվանմամբ:

