Տեսություն
Ատոմի միջուկի շուրջը գտնվող էլեկտրոնների համախումբը առաջացնում է էլեկտրոնային թաղանթը:
Էլեկտրոնների թիվը ատոմի էլեկտրոնային թաղանթում հավասար է ատոմի միջուկում պրոտոնների թվին, որը որոշվում է Մենդելեևի պարբերական համակարգում տարրի կարգաթվով կամ ատոմային համարով:
Այսպես, ջրածնի ատոմի էլեկտրոնային թաղանթը կազմված է մեկ էլեկտրոնից, կալցիումինը՝ 20, արծաթինը՝ 47:
Իսկ ինչպե՞ս են շարժվում էլեկտրոնները: Քաոսայի՞ն, վառվող լամպի շուրջը պտտվող մժեղների նմա՞ն, թե՞ որոշակի կարգավորվածությամբ: Այդ հարցի պատասխանը կարելի է գտնել՝ դիտարկելով էլեկտրոնի էներգիական բնութագիրը:
Էլեկտրոններն ատոմում տարբերվում են իրենց էներգիայով: Ինչպես ցույց են տալիս փորձնական արդյունքները, որոշ էլեկտրոններ ավելի ուժեղ են ձգվում միջուկի կողմից, մյուսները՝ ավելի թույլ: Այս երևույթի գլխավոր պատճառը էլեկտրոնների տարբեր հեռավորությունն է ատոմի միջուկից:
Ինչքան էլեկտրոնները մոտ են ատոմի միջուկին, այնքան ավելի ամուր են կապված և նրանց դժվար է պոկել էլեկտրոնային թաղանթներից, իսկ ինչքան էլեկտրոնները հեռու են միջուկից, այնքան նրանց հեշտ է պոկել:
Միջուկին առավել մոտ պտտվող էլեկտրոնները կարծես թե շրջափակում են միջուկը մյուս էլեկտրոններից, որոնք միջուկի կողմից ավելի թույլ են ձգվում, և հետզհետե հեռավորությունը միջուկից մեծանում է:

Այսպես են առաջանում էլեկտրոնային շերտերն ատոմի էլեկտրոնային թաղանթում:
Ատոմի էլեկտրոնային թաղանթում էլեկտրոնները բաշխված են էլեկտրոնային շերտերի ձևով:Առաջինը միջուկին մոտ գտնվող էլեկտրոնային շերտն է, որում էլեկտրոնն օժտված է նվազագույն էներգիայով:
Վերջին՝ միջուկից ամենահեռու գտնվող էլեկտրոնային շերտն անվանվում է արտաքին:Այսինքն էլեկտրոններն ըստ էներգիական մակարդակների բաշխվում են նվազագույն էներգիայի սկզբունքով:

Ատոմի այդ վիճակն անվանում են հիմնական վիճակ: Յուրաքանչյուր էլեկտրոնային շերտում գտնվում են էներգիայի արժեքով միմյանց մոտ էլեկտրոններ: Այդ պատճառով էլ էլեկտրոնային շերտն անվանվում է նաև էներգիական մակարդակ:
Էներգիական մակարդակների թիվը քիմիական տարրի ատոմում հավասար է պարբերական աղյուսակում այդ տարրի պարբերության համարին:
Օրինակ Նատրիումը գտնվում է 3-րդ պարբերությունում հետևաբար ատոմում առկա 11 էլեկտրոնները բաշխված են երեք էներգիական մակարդակներում:
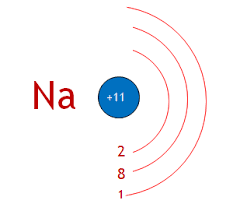
Տվյալ էներգիական մակարդակում գտնվող էլեկտրորրերի առավելագույն թիվը որոշվում է 2n2 բանաձևով, որտեղ n-ը մակարդակի համարն է:Առաջին էլեկտրոնային շերտում երկուսից ավելի էլեկտրոն չի կարող լինել:
Ցանկացած ատոմի արտաքին էլեկտրոնային շերտում (բացառությամբ որոշ տարրերի ատոմների) էլեկտրոնների թիվը չի կարող 8-ից մեծ լինել:Էլեկտրոնների թիվը գլխավոր ենթախմբերի տարրերի արտաքին էներգիական մակարդակում հավասար է խմբի համարին:Գրառումը, որն արտացոլում է քիմիական տարրի ատոմում էլեկտրոնների բաշխումն ըստ էներգիական մակարդակների և ենթամակարդակների, կոչվում է այդ ատոմի էլեկտրոնային փոխդասավորվածություն (էլեկտրոնային բանաձև):ՕրինակՆատրիում տարրի ատոմի էլեկտրոնային բանաձևն է ` 1s22s22p63s1:
